著名钢琴家贝多芬在32岁时几乎完全失去了他的听力,对一名音乐家而言,这种伤害不言而喻。贝多芬在给家人的遗嘱中写道:“正如落叶凋零,我的生命也变得空洞。”
尽管我们现代人并不清楚贝多芬听力损失的原因,但现实中有相当一部分听损患者的听力损失都和遗传DNA有关,而目前已知的听障基因有近百个。虽然目前医学技术有了飞跃的进步,但即使是在贝多芬逝世两个世纪后的今天,我们仍然无法治愈或逆转遗传性听力损失。
儿童听损的遗传是父母双方的结果,并非一方导致
虽然我们并不能治愈已经发生的遗传性听损,但可以有效避免即将可能发生但还未发生的听力损失,这就是阻止遗传听障基因技术。
这种技术无法逆转已发生的听损,但是如果有人第一胎为听损新生儿,想要避免第二胎出现听损的可能,可以试一试阻断遗传技术,当然,这属于试管婴儿技术与基因工程一类,简单来说,就是将原有的听障基因去除,达到避免新生儿听力损失的目的。但是要注意的是,这种方法不能阻断所有听障基因,只能降低新生儿成为听障儿童的可能性,且需要符合相应的适应证要求。
贝多芬小鼠12月21日,哈佛大学医学院耳鼻喉科副教授Zheng-Yi Chen和哈佛大学化学与化学生物学教授、美国博德研究所核心成员David R·Liu共同主导的一项研究在线发表在在国际著名期刊《自然》(Nature),该团队用基因编辑技术治疗TCM1突变“贝多芬小鼠”的遗传性听损,取得了一定效果。这类治疗也属于阻断听损基因的一部分。
内耳是声音感知的最重要部位,其中内耳毛细胞又是人类听到声音的关键。其中,TCM1是内耳毛细胞中机械力传导的重要组成部分,TCM1蛋白在内耳毛细胞的纤毛上形成通道,当声波引起纤毛运动时这种通道就会打开,随后钙离子进入细胞生成电信号,电信号传递到大脑后形成听觉。
TCM1发生了一种显性负性错义突变后,会导致内耳毛细胞单通道电流水平和钙渗透率降低,进一步导致感音神经性语后听障(语言形成后出现听力障碍)。通常,TCM1显性突变患者在10-15岁时会开始逐渐听损加重。
TCM1显性突变即意味着,一对等位基因中只有一个发生突变就会导致功能丧失,从而导致听力障碍。这也就使得修复显性突变成了一项精细的任务:必须使突变基因失活,同时还要保留野生型基因。这一对基因的差别只在于其中一个核苷酸的不同。突变的TCM1在原本野生型一个胸腺嘧啶核苷酸T的位置变成了腺嘌呤核苷酸A。
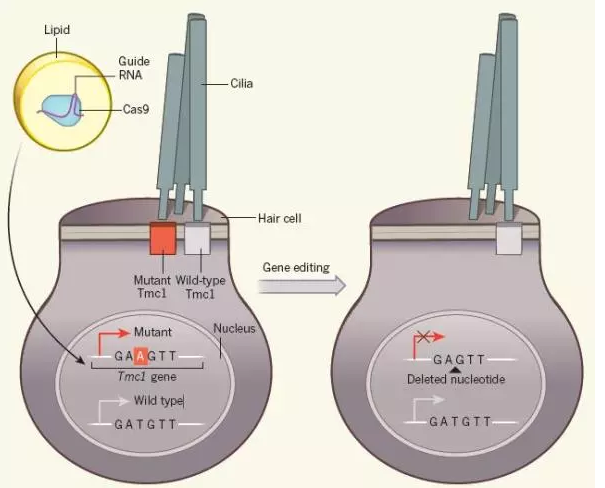
Chen和Liu团队启用的是热门的CRISPR–Cas基因编辑技术。研究团队将含有Cas9和RNA的脂滴注入新生TCM1贝多芬小鼠的内耳,这种脂滴能和细胞随后融合。基因编辑后突变基因中腺嘌呤核苷酸A被敲除,从而使该基因失活。但同时保留了野生型基因,保证正常听力功能实现。
研究团队评估得出,基因编辑过的小鼠中内耳毛细胞的存活率更高、听脑干反应阈值更低。此外,听觉反射也出现改善,基因编辑过的成年贝多芬小鼠在听到突发噪音时会表现出惊吓,然而未经基因编辑的小鼠对此毫无反应。
论文最后指出,这一治疗途径在治疗和内耳毛细胞功能障碍有关的常染色体显性遗传听障方面具备潜力,也为反义寡核苷酸疗法和RNA干扰疗法提供了补充策略。
基因阻断治疗并不能解决现在已发生的听力损失,但是可以避免后代再发生听损,这是一个希望,尽管现在还受到很多适应证限制,且成本较高,但在中国已有成功案例,相信在未来技术成熟后会进行推广,让我们或听损儿童的后代最大程度上不再受听损困扰。
[责任编辑: 李燕群]
